
12月1日,中国食品药品检定研究院(下称中检院)发布《化妆品新原料界定及研究技术指导原则(征求意见稿)》(下称:新《指导原则》)和《化妆品新原料沟通交流工作机制(试行)》。其实早在今年的1月19日,中检院就发布了关于公开征求《化妆品新原料判定研究技术指导原则(征求意见稿)》意见的通知(下称:旧《指导原则》)。时隔将近一年,正式稿未出来,中检院再次发布征求意见稿,整体来看,两版的差异性还是蛮大的,今天我们结合差异点来看下新原料注册人备案人在接下来的工作中需要关注哪些重点事项。
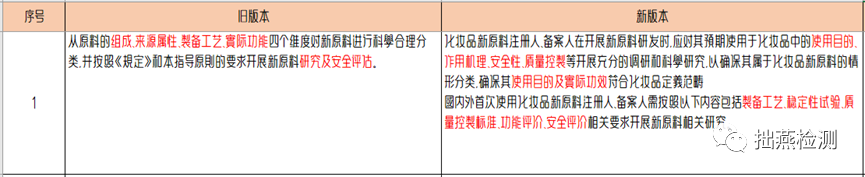
新《指导原则》的指导目的更全面,也跟新原料注册备案资料管理规定中的内容更契合。要求注册人备案人从制备工艺、稳定性试验、质量控制标准、功能评价、安全评价等方面展开研究。目的是为了通过研究清晰认知确保原料使用目的和功效属于化妆品定义范畴。
如果原料从一开始就不属于化妆品定义,那么前期做的所有研究工作都是徒劳,得不偿失。
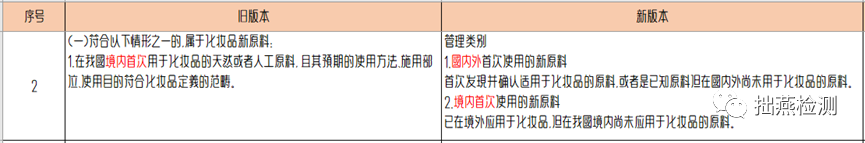
新《指导原则》对新原料的分类进行了重新规划,从“管理类别”、“管理属性”和“不属于化妆品新原料的情形”方面着手进行分类。针对管理类别,《指导原则》从定义上细化了新原料的分类,分为国内外首次和境内首次使用新原料。
 旧《指导原则》提到只要调整已使用化妆品原料的使用目的或安全使用量等的原料。而此次的《指导原则》则表明,调整已使用原料的使用目的为防腐、防晒、着色、染发、祛斑美白的才算新原料。根据化妆品注册备案管理办法,这些功效的新原料是需要按照注册管理的。那么如果增加已使用原料的普通功效或者安全使用量,应该怎么操作呢,这个大家可能会有疑惑,看后续是否会有相关的答疑出来。
旧《指导原则》提到只要调整已使用化妆品原料的使用目的或安全使用量等的原料。而此次的《指导原则》则表明,调整已使用原料的使用目的为防腐、防晒、着色、染发、祛斑美白的才算新原料。根据化妆品注册备案管理办法,这些功效的新原料是需要按照注册管理的。那么如果增加已使用原料的普通功效或者安全使用量,应该怎么操作呢,这个大家可能会有疑惑,看后续是否会有相关的答疑出来。
 新《指导原则》新增了另外“改进创新的新原料”,就是通过优化原料的制备技术和生产工艺,且改变原料物质基础等方面开展实质创新性研究,同时提升原料安全、功效、稳定、质量可控性。这里可以理解为通过优化工艺来提升有效物质的种类或者含量,从而提升原料的性能可以归属为新原料。比如人参提取物是已使用原料目录中的一种原料,水羊生物最近申报成功的新原料黑参提取物就是通过工艺的优化提升了人参中有效物质人参皂苷种类和含量,因此可以归属为改进创新的新原料。
新《指导原则》新增了另外“改进创新的新原料”,就是通过优化原料的制备技术和生产工艺,且改变原料物质基础等方面开展实质创新性研究,同时提升原料安全、功效、稳定、质量可控性。这里可以理解为通过优化工艺来提升有效物质的种类或者含量,从而提升原料的性能可以归属为新原料。比如人参提取物是已使用原料目录中的一种原料,水羊生物最近申报成功的新原料黑参提取物就是通过工艺的优化提升了人参中有效物质人参皂苷种类和含量,因此可以归属为改进创新的新原料。
 针对不属于化妆品新原料的情形,新《指导原则》做了详细的介绍和举例。让大家可以更清晰地知道哪些情形是不能归属为化妆品新原料的。
针对不属于化妆品新原料的情形,新《指导原则》做了详细的介绍和举例。让大家可以更清晰地知道哪些情形是不能归属为化妆品新原料的。
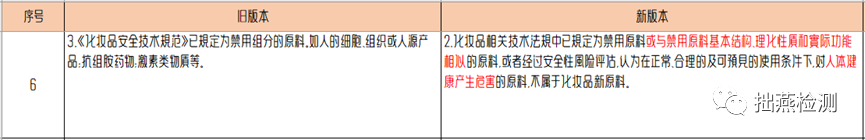
新《指导原则》指出不属于化妆品新原料的情形,除了《化妆品安全技术规范》已规定为禁用组分的原料外,原料的基本结构,理化性质和实际功能相似,经安全风险评估对人体健康产生危害的,也不属于化妆品新原料。由此可见,对于新原料的申报,安全性属于优先考虑的范畴。
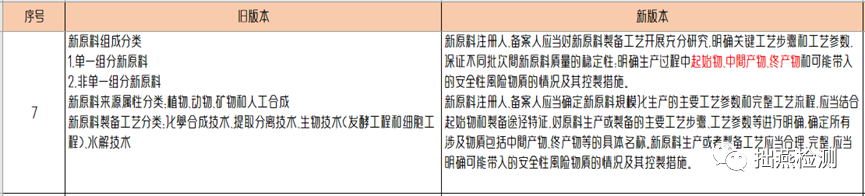
旧《指导原则》重点集中于对原料的制备类别和合成工艺方面展开描述。新原料制备工艺分为:化学合成技术、提取分离技术、生物技术(发酵工程和细胞工程)、水解技术。针对每一种工艺技术进行详细描述并提出相关工艺要求。而新《指导原则》则是笼统描述,一段带过,对于工艺简述的编写指导性减弱,比如里面提到明确生产过程中起始物、中间产物、终产物和可能带入的安全性风险物质的情况及其控制措施。这个更契合化学合成原料的工艺描述,并非对所有新原料适用,因为不是所有类型的新原料都有起始物、中间产物和终产物。
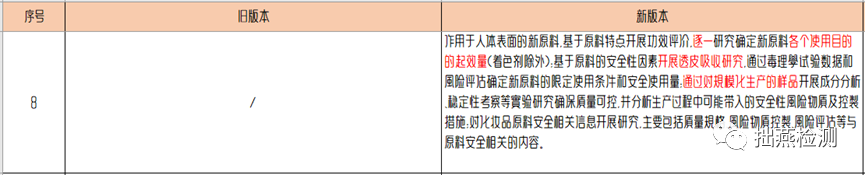
新《指导原则》要求需要对作用于人体表面的新原料开展功效评价,逐一研究各个使用目的的起效量;起效量一般采取二分法,开展梯度浓度的功效测试,逐步缩窄范围,从而得出对应功效的起效量。另外需要基于原料的安全性因素开展透皮吸收研究,按照《化妆品安全评估技术导则》中描述,原料和/或风险物质的透皮吸收试验,可采用国际通用的透皮吸收试验方法获取相应的数据。
另外,稳定性考察试验用的样品需要来自规模化生产,如何理解规模化生产,首先稳定性考察样品不应该来自于实验室,因为实验室打样的样品和实际生产的原料,工艺设备参数有会一定的差异从而导致原料的成分、稳定性也会不一样。规模化在这里可以理解为在工厂产线正式生产出来的原料,不一定需要特别大的量,可以是小试产品,但所使用的生产设备、工艺设备参数等都需要跟大货生产的保持一致。

据了解,原料的INCI名称申请周期很长,申请人根据原料的类型收集相应资料,在PCPC网站上提交申请,申请周期约3-6个月。另外,INCI名称也不是随时都可以申请,INC通常在2月、4月、6月、9月和11月举行会议,申请人需要在会议开始前的6-8周提交INCI名称申请,INCI名称分配结果和相应原料专论的拟定一般在INC会议结束后的1个月左右完成。如此繁琐的申请流程,势必会对新原料的备案进度产生影响,那新原料到底要不要INCI名称呢,新《指导原则》给出了答案,如果原料已经被《国际化妆品原料字典和手册》收录,应明确原料的INCI名称及其ID号码。如果没有被收录,可以不需要明确INCI名称。很多人会有疑问,化妆品备案时,配方栏也有INCI名称栏,是否也说明一定需要填写,其实不然,已使用原料目录中就有部分原料是没有INCI名称,如果实在没有,是可以在空出来不填写,系统可以自动识别哪些原料是不需要填写INCI名称。

《化妆品新原料注册备案资料管理规定》(下称管理规定)中提到国内外首次使用的有健康危害效应(不包括局部毒性)的新原料,应当提供上述第1~12项毒理学试验资料,还应当提交毒物代谢及动力学试验资料。国内外首次使用的具有较高生物活性的寡肽、多肽、蛋白质类新原料,应当提供上述第1~12项毒理学试验资料,还应当同时提交皮肤吸收/透皮试验和免疫毒性试验资料。在管理规定中只有有健康危害效应和高生物活性的新原料才需要做代谢和透皮相关试验。新《指导原则》则显示得更为严格,只要是作用于人体表面得新原料,都需要做经皮/透皮吸收、分布和代谢途径相关的研究。

新《指导原则》明确国内首次使用原料需要提供的资料清单。
从上面的差异性分析可以知道,中检院在本次的指导原则中更看重新原料的功效性和安全性研究,很多地方都有从严的要求,这无疑会给注册人备案人很大的挑战,但是挑战的同时也是机遇。虽然不少业内人士都表示化妆品的管理越来越朝着医药类的严格程度靠近,这也让化妆品行业承担着越来越重的检测、研发压力,但对于行业和消费者而言,也意味着将迎来功效更明确、更清朗的市场环境。
小编一直致力于向所有阅读者普及化妆品法规知识、解读相关法规政策、更新行业法规动态。
合
规
扫一扫,获取更多精彩内容

拙燕检测技术(长沙)有限公司










